Wat zeldzame mutaties ons kunnen leren over hersenontwikkeling en ziekten
21 August 2018
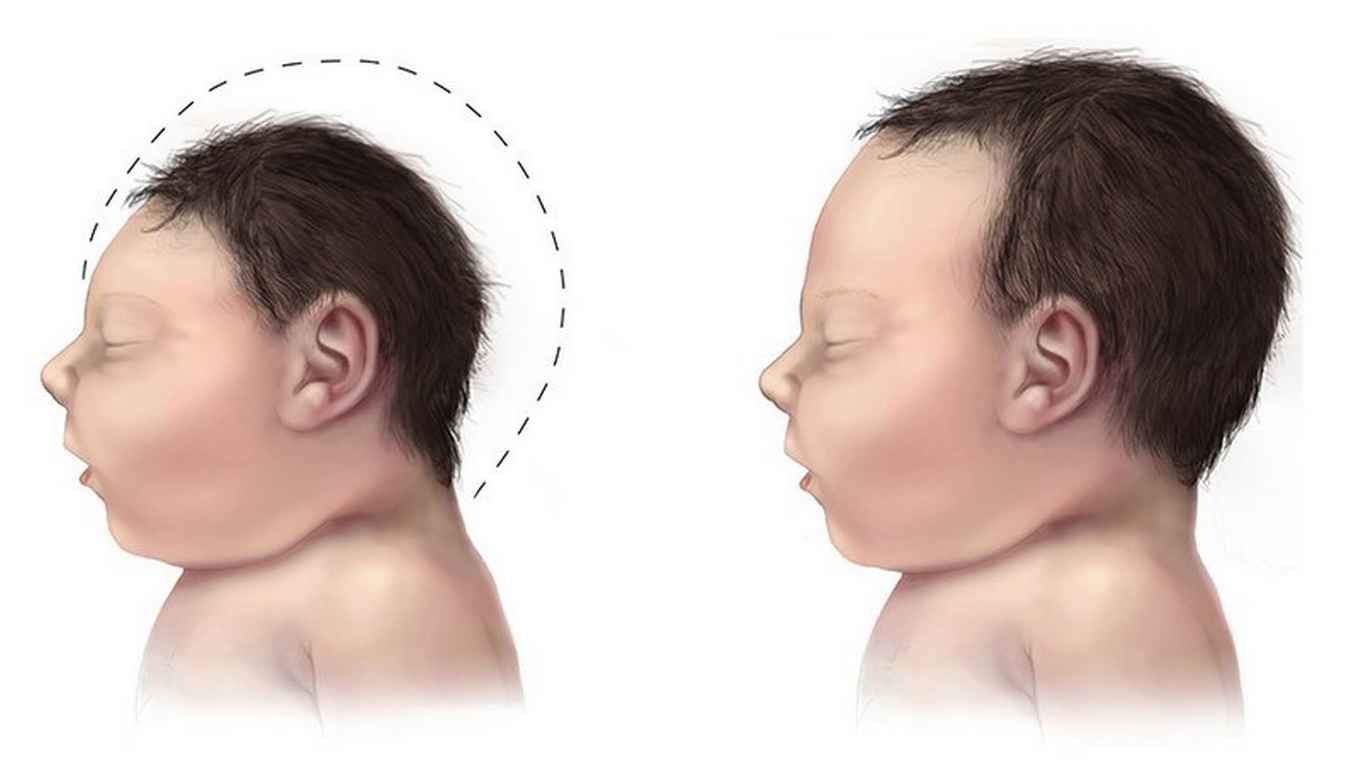
In eerder onderzoek werd al aangetoond dat functieverliesmutaties in het gen CHMP1A een oorzaak zijn van een hersenontwikkelingsstoornis in drie afzonderlijke families (Mochida et al, 2012). Delen van de hersenen, zoals het cerebellum en de pons, zijn sterk verkleind. Ook is de cerebrale cortex kleiner, wat we microcefalie noemen. Een onderzoek onder leiding van Christopher Walsh aan de Harvard Medical School, in samenwerking met het laboratorium van Frank Jacobs aan de Universiteit van Amsterdam, heeft verder bewijs opgeleverd dat CHMP1A nodig is voor een normale ontwikkeling van de hersenen.
Inzichten in microcefalie
Bij microcefalie, een medische aandoening waarbij de hersenen zich niet goed ontwikkelen, met als gevolg een kleiner hoofd dan normaal, is het fenotype vaak grotendeels hetzelfde: de neocortex blijft te klein, doordat het aantal hersencellen (neuronen) in deze structuur lager is. Ook op moleculair niveau is er een aantal gemeenschappelijke kenmerken. De oorzaak van de aandoening ligt vaak in een onbalans tussen celprocessen die verantwoordelijk zijn voor celdeling en -differentiatie. De onderliggende mechanismen van deze onbalans kunnen echter per individu aanzienlijk verschillen. Zo kan microcefalie worden veroorzaakt door een defect in eiwitten die direct van invloed zijn op de celdeling (zoals eiwitten die onmisbaar zijn voor mitose, een proces dat een delende cel opsplitst in twee cellen) of door een defect in een eiwit dat een rol speelt in het behoud van stamcelidentiteit.
Mutaties in bepaalde genen komen vaker voor. Over de rol van die genen bij microcefalie is daarom veel bekend. Zeldzame mutaties, zoals in het gen CHMP1A, zijn nog niet uitgebreid bestudeerd of zijn zelfs nog niet aangetoond. Door onderzoek naar het effect van verschillende mutaties die verband houden met microcefalie worden fundamentele inzichten verkregen in de organisatie van de menselijke hersenen. Dit onderzoek heeft duidelijk gemaakt hoe CHMP1A werkt en die informatie zou in aanverwant nieuw onderzoek kunnen worden gebruikt. Bovendien tast de familie van patiënten met een zeldzame neurologische aandoening vaak in het duister over de oorzaak. Op die vraag geeft deze informatie ook deels antwoord.
'Mini-hersenmodellen'
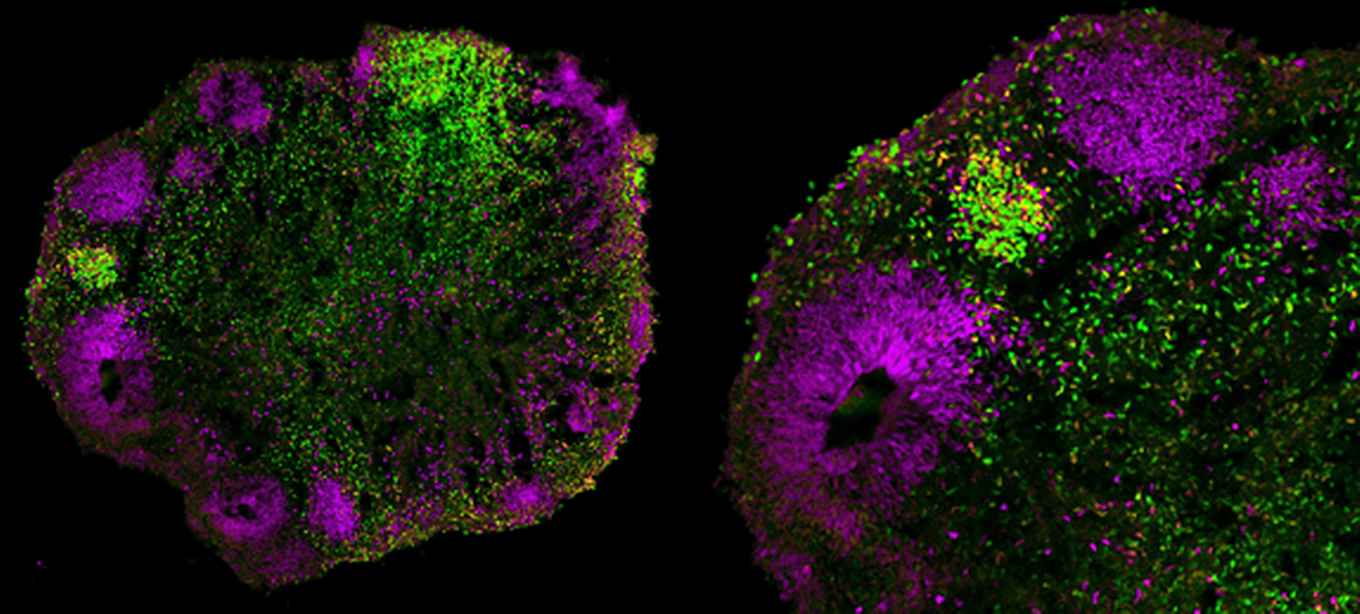
Frank Jacobs en Gerrald Lodewijk van het Swammerdam Institute for Life Sciences hebben onderzoek gedaan naar de functie van het gen CHMP1A met behulp van organoïden van de menselijke hersenen, ook vaak ‘minihersenen’ genoemd. Deze organoïden worden gebruikt als een model van de menselijke hersenen in ontwikkeling. Ze zijn afgeleid uit menselijke embryonale stamcellen, die in staat zijn elk type cel in het menselijk lichaam te produceren. Met specifieke celkweekomstandigheden kan ervoor worden gezorgd dat de organoïden hersenschorsstructuren gaan vormen - het gebied dat bij microcefalie vooral wordt getroffen.
Met behulp van CRISPR/Cas9, een methode om DNA te muteren, introduceerden onderzoekers aan de Harvard Medical School een CHMP1A functieverliesmutatie in stamcellen, vergelijkbaar met wat we zien bij patiënten met de neurologische aandoening. Jacobs en Lodewijk kweekten organoïden met deze gemuteerde cellen en vergeleken vervolgens de groei en ontwikkeling van deze organoïden met die van organoïden afgeleid van controlestamcellen. De analyse wees erop dat de gemuteerde organoïden te snel differentieerden: ze genereerden vroeger neuronen dan de controle-organoïden, terwijl de hoeveelheid stamcellen leek te zijn afgenomen.
Het eiwit Sonic Hedgehog (SHH)
Uit experimenten van de samenwerkende onderzoekers bleek dat CHMP1A noodzakelijk is voor de productie van het eiwit Sonic Hedgehog (SHH). Uit andere studies is bekend dat het belangrijk is voor zelfvernieuwing en proliferatie van neuronale stamcellen. Deze kennis werd toegepast op de organoïdecultuur, door een verbinding toe te voegen die het effect van het eiwit Sonic Hedgehog nabootst. Dit zorgt voor activering van de SHH-signalisatiecascade en de bijbehorende stroomafwaartse effecten.
Aangezien bekend is dat dit de zelfvernieuwing van neuronale stamcellen stimuleert, was het interessant om na te gaan of er verschillen waren in de manier waarop de gemuteerde minihersenen en de minihersenen in de controlegroep op de verbinding reageerden. Hoewel beide groepen na behandeling een vergelijkbaar niveau van SHH-signaalactiviteit lieten zien, ging alleen bij de controle-organoïden de expressie van veel genen die betrokken zijn bij celdeling omhoog. In organoïden met het gemuteerde CHMP1A-gen was dit effect veel zwakker, wat ook weer wijst op een probleem met het behoud van de neuronale stamcellen. Uiteindelijk betekent dit dat CHMP1A nodig is voor een normale ontwikkeling van de hersenen.
Publicatiedetails
Coulter et al., ‘The ESCRT-III Protein CHMP1A Mediates Secretion of Sonic Hedgehog on a Distinctive Subtype of Extracellular Vesicles’ in Cell Reports, 24 July 2018, Doi: 10.1016/j.celrep.2018.06.100